بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله تعالى وبركاته
حل أسئلة 3-3 درس كيف تختلف الذرات؟ – تركيب المادة.
نبدأ على بركة الله ...
مثال 1-3
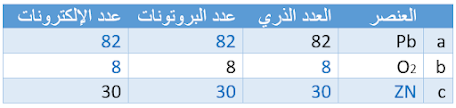
العدد الذري أكمل الجدول الآتي:
مسائل تدريبية
12. ما عدد البروتونات والإلكترونات في كل من ذرتي العنصرين الآتيين؟
a. الرادون Rn.
b. الماغنسيوم Mg.
الحل:
· الرادون Rn يمكننا معرفة عدده الذري بمجرد النظر إليه في الجدول الدوري وهو العدد الموجود فوق الرمز.
العدد الذري = عدد البروتونات = عدد الإلكترونات = 86
· الماغنسيوم Mg
العدد الذري = عدد البروتونات = عدد الإلكترونات = 12
13. ما العنصر الذي تحتوي ذرته على 66 إلكتروناً؟
الحل:
العنصر الذي يحتوي على 66 إلكترون يكون عدده الذري = 66 لذلك فهو الديسبروسيوم Dy.
14. ما العنصر الذي تحتوي ذرته على 14 بروتوناً؟
الحل:
العنصر الذي يحتوي على 14 إلكترون يكون عدده الذري = 14 هو السيلكون Si.
15. تحفيز هل الذرات المبينة في الشكل عن اليسار لها العدد الذري نفسه؟
الحل:
في الحالة الأولى عدد البروتونات = 9 = عدد الإلكترونات الموجودة أما في الحالة الثانية، ولكن هناك اختلاف في عدد النيترونات لذلك يمكن أن تكون هذه الذرة نظيرة للأخرى لأنه لا يوجد ذرتان لهما نفس العد الذري.
الشكل 17 -3: اعمل قائمة بعدد البروتونات والنيوترونات والإلكترونات لكل نظير من نظائر النحاس.
الحل:
|
|
Cu – 63 |
Cu - 65 |
|
البروتونات |
29 |
29 |
|
الإلكترونات |
29 |
29 |
|
النيترونات |
34 |
36 |
مسائل تدريبية
16. حدد عدد كل من البروتونات، والإلكترونات، والنيوترونات للنظائر من (b) إلى (f) في الجدول أعلاه. وسم كل نظير، واكتب رمزه.
الحل:
· B – الكالسيوم:
عدد البروتونات = 20.
عدد الإلكترونات = 20.
عدد النيترونات = 46 – 20 = 26.
· C – الأكسجين:
عدد البروتونات = 8.
عدد الإلكترونات = 8.
عدد النيترونات = 17 – 8 = 9.
· D – الحديد:
عدد البروتونات = 26.
عدد الإلكترونات = 8.
عدد النيترونات = 57 – 26 = 31.
· E – الخارصين:
عدد البروتونات = 30.
عدد الإلكترونات = 30.
عدد النيترونات = 64 – 30 = 34.
17. تحفيز العدد الكتلي لذرة يساوي 55، وعدد النيوترونات هو العدد الذري مضافاً إليه خمسة. ما عدد البروتونات، والإلكترونات والنيوترونات في الذرة؟ وما رمز العنصر؟
الحل:
العدد الكتلي = 55
أي أن عدد البروتونات + عدد النيترونات = 5
عدد البروتونات = س + عدد النيترونات
= س + 5
س + (س + 5) = 55
س = 25
عدد البروتونات = 25
عدد النيترونات = 25 + 5 = 30.
عدد الإلكترونات = العدد الذري = عدد البروتونات = 25.
العنصر هو المنجنيز Mn ويرمز له
ماذا قرأت؟
ماذا قرأت؟ وضح كيف تحسب الكتلة الذرية؟
الحل:
نحسب الكتلة الذرية للعنصر من خلال معرفة الكتلة الذرية للنظائر حيث إن الكتل الذرية متوسط كتل النظائر لهذا العنصر. نحدد نسبة وجود النظير في العنصر. نحدد نسبة وجود النظير في العنصر ومن خلاله نحدد كتلته الذرية ليست بالضرورة تكون عدد صحيح.
تجربة
1. احسب نسبة وجود كل مجموعة مستعيناً بالبيانات من الخطوة (2). وللقيام بذلك اقسم عدد حبات كل مجموعة على العدد الكلي لحبات الخرز.
الحل:
لدي مجموعة من الخرز عددها = 50 خرز.
10 خرزات خضراء، 10 حمراء، 10 صفراء، 10 سوداء، 10 بيضاء.
نسبة وجود كل خرز = عدد الخرز من نفس النوع / العدد الكلي للخرز.
نسبة وجود خرزة خضراء = نسبة وجود خرزة حمراء = نسبة وجود خرزة صفراء = نسبة وجود خرزة سوداء = نسبة وجود خرزة بيضاء = 50 / 10 = 20%.
2. حدد الكتلة الذرية للخرز من خلال نسبة وجود كل نظير والبيانات من الخطوة (3). وللقيام بذلك استخدم المعادلة الآتية.
الإسهام في الكتلة = الكتلة × نسبة وجود النظير.
الحل:
في الكتلة = 20 × 0.02 = 0.004
كتلة الخرز الأحمر = 0.01 جم.
إسهام الخرز الأحمر في الكتلة = 0.01 × 0.2 = 0.002
كتلة الخرز الأصفر = 0.03 جم.
إسهام الخرز الأصفر في الكتلة = 0.03 × 0.2 = 0.006
كتلة الخرز الأسود = 0.04 جم.
إسهام الخرز الأسود في الكتلة = 0.04 × 0.2 = 0.008
كتلة الخرز الأبيض = 0.01 جم.
إسهام الخرز الأبيض في الكتلة = 0.01 × 0.2 = 0.002
الكتلة الذرية للخرز = 0.004 + 0.006 + 0.008 + 0.002
= 0.022 جم
3. استنتج هل تختلف الكتلة الذرية إذا حصلت على كيس آخر يحتوي على عدد مختلف من النوع نفسه من الخرز؟ علل إجابتك.
الحل:
لو كانت في الكيس الأخر نسبة كل خرزة مختلفة عن الكيس الأول سوف تختلف الكتلة الذرية لأن اسهام كل كتلة في الكتلة الذرية سوف يختلف.
4. فسر لماذا تم تحديد متوسط كتلة كل مجموعة من الخرز بقياس كتلة 10 حبات بدلاً من حبة واحدة من كل مجموعة؟
الحل:
كتلة 10 حبات تعني متوسط الكتل وذلك لضمان الدقة فربما كانت خرزة أكبر أو أصغر من كتل نفس المجموعة كانت هذه الخرزة متشابهة في اللون وتختلف في الكتلة.
18. للبورون B نظيران في الطبيعة: هما البورون – 10 (نسبة وجوده 19.8%) وكتلته amu 10.013. والبورون – 11 (نسبة وجوده %80.2) وكتلته amu 11.009. احسب الكتلة الذرية للبورون.
الحل:
· البورن – 10:
كتلته = amu 10.013.
نسبته = 19.8%.
اسهامه في الكتلة = كتلته × نسبته = 10.013 × 0.198
= 1.982574 aum.
· البورن – 11:
كتلته = amu 11.009.
نسبته = 80.2%.
اسهامه في الكتلة = كتلته × نسبته = 11.009 × 0.802
= 8.8292 aum.
الكتلة الذرية للبورون = اسهام البورن – 10 + اسهام البورن – 11
= 1.9825 + 8.8292 = 10.811 aum.
19. تحفيز للنيتروجين نظيران في الطبيعة، هما نيتروجين -14، ونيتروجين -15. وكتلته الذرية amu 14.007. أي النظيرين له نسبة وجود أكبر في الطبيعة؟ فسر إجابتك.
الحل:
نسبة نيتروجين – 14 الأكثر في الطبيعة. لأن كتلته قريبة جداً من الكتلة الذرية للنيتروجين.
التقويم 3-3
20. الفكرة الرئيسة فسر كيف يمكن معرفة نوع الذرة؟
الحل:
يمكن معرفة وتمييز الذرة من خلال معرفة العدد الذري لها، فكل ذرة لها عدد ذري واحد ولا تتشابه ذرتين في نفس العدد الذري، أي أن العدد الذري صفة مميزة مثل بصمة الأصبع.
21. تذكر أي الجسيمات الذرية تحدد ذرة عنصر معين؟
الحل:
البروتونات هي التي تحدد ذرة عنصر معين وهي تساوي العدد الذري.
22. فسر كيف أن وجود النظائر مرتبط مع حقيقة أن الكتل الذرية ليست أرقاماً صحيحة؟
الحل:
الكتل الذرية هي متوسط كتل النظائر، ولأن كل نظير له كتلة مختلفة عن الآخر فإن وجود رقم صحيح صعب.
23. احسب للنحاس نظيران: النحاس -63 (نسبة وجوده %69.2، وكتلته amu 62.93) والنحاس -65 (نسبة وجوده %30.8، وكتلته amu 64.928). احسب الكتلة الذرية للنحاس.
الحل:
|
|
النظير الأول |
النظير الثاني |
النظير الثالث |
الكتلة الذرية للماغنسيوم |
|
الكتلة |
23.985 amu |
24.986 amu |
25.982 amu |
الكتلة الذرية للنحاس = 43.4217 + 20.0498 = amu 63.47 |
|
النسبة |
79.99 |
10.00 |
11.01 |
|
|
الاسهام في الكتلة |
19.1856 |
2.4986 |
2.8606 |
24. احسب للماغنسيوم ثلاثة نظائر: الأول كتلته amu 23.985 ونسبة وجوده % 79.99، والثاني كتلته amu 24.986 ونسبة وجوده %10.00، والثالث كتلته amu 25.982 ونسبة وجوده %11.01. احسب الكتلة الذرية للماغنسيوم.
الحل:
· النحاس – 63:
كتلته: amu 62.93.
نسبته: 69.2.
اسهامه في الكتلة الذرية = كتلة النحاس × نسبته
= 62.93 × 0.692
= 43.5475
· النحاس – 65:
كتلته: 64.928 amu.
نسبته: 30.8.
اسهامه في الكتلة الذرية = كتلة النحاس × نسبته
= 64.928 × 0.308
= 19.9978
· الكتلة الذرية = اسهام النظير الأول + اسهام النظير الثاني
= 43.5475 + 19.9978
= amu 63.5453
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"
بالتوفيق للجميع...^-^










ليست هناك تعليقات:
إرسال تعليق