بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله وبركاته
ملخص 3-4 التفاعلات في المحاليل - التفاعلات الكيميائية
نبدأ على بركة الله ...
المحلول المائي: يحتوي على مذيب ومذاب.
المذاب: مادة أو أكثر مذابة في الماء.
المذيب: أكبر مكونات المحلول.
المركبات الجزيئية في المحلول
· الماء هو المذيب في المحاليل المائية دائما.
فالسكروز والإيثانول هما مركبان يذوبان في المحلول في صورة جزيئات وهناك مواد جزيئية (تساهمية) تكون أيونات عندما تذوب.
فالمركب الجزيئي كلوريد الهيدروجين مثلا يكون أيونات الهيدروجين وأيونات الكلوريد عندما يذوب في الماء.
HCl(aq)→H+ (aq) + Cl-(aq)
محلول كلوريد الهيدروجين المائي يسمى حمض الهيدروكلوريك HCl(aq).
المركبات الأيونية في المحلول
تتكون المركبات الأيونية من أيونات موجبة وأيونات سالبة مرتبطة معا بروابط أيونية.
عندما تذوب المركبات الأيونية في الماء فإن أيوناتها تنفصل بعضها عن بعض وتسمى هذه العملية التفكك.
فالمحلول المائي لكلوريد الصوديوم يحتوي على أيونات -CI و +Na
عند دمج محلولين مائيين يحویان مواد ذائبة فإن الأيونات قد يتفاعل بعضها مع بعض وكثير من هذه التفاعلات تفاعلات إحلال مزدوج. ويمكن أن تؤدي إلى ثلاثة أنواع من النواتج هي: راسب أو ماء، أو غاز.
المعادلة الأيونية الكاملة: هي المعادلة التي تبين الجسيمات في المحلول.
الأيونات المتفرجة: هي التي لم تشارك في التفاعل عند شطب هذه الأيونات من طرفي المعادلة الأيونية تحصل على ما يسمى المعادلة الأيونية النهائية.
التفاعلات التي تكون رواسب:
التفاعلات التي تكون ماء:
هذا النوع من تفاعلات الإحلال المزدوج يؤدي إلى تكوين جزيئات الماء.
التفاعلات التي تكون غازات:
هذا النوع من تفاعلات الإحلال المزدوج يؤدي إلى تكوين غازات.
· من التفاعلات التي تنتج غاز تفاعل الأحماض مع الكربونات أو البيكربونات لينتج غاز ثاني أكسيد الكربون CO2 ويتكون كذلك الماء H2O والملح.
الخلاصة
· الماء هو المذيب في المحاليل المائية دائما.
· بعض المركبات الجزيئية تكون أيونات عندما تذوب في الماء بينما يذوب كثير من المركبات الأيونية في الماء وتنفصل أيوناتها.
· عند مزج محلولين يحتويان على أيونات ذائبة، قد ت تفاعل الأيونات معا، أما جزيئات المذيب فلا تتفاعل عادة.
· التفاعلات التي تحدث في المحاليل المائية هي تفاعلات الإحلال المزدوج.
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"
بالتوفيق للجميع...^-^
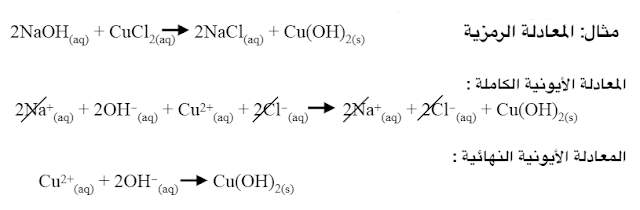












ليست هناك تعليقات:
إرسال تعليق