بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله وبركاته
حل أسئلة الفصل الرابع – التفاعلات الكيميائية
نبدأ على بركة الله ...
إتقان المفاهيم
61. عرّف المعادلة الكيميائية.
الحل:
هي معادلة يستخدمها الكيميائيون لتمثيل التفاعل الكيميائي وتبين المتفاعلات والنتائج والشروط اللازمة لحدوث التفاعل..
62. ميّز بين التفاعل الكيميائي والمعادلة الكيميائية.
الحل:
التفاعل الكيميائي هو حدوث تغيير في المادة الكيميائية وهناك مؤشرات تدل على حدوث هذا التغيير أما المعادلة الكيميائية هي التي توصف التفاعل في صورة معادلة بين المتفاعلات والنتائج.
63. وضح الفرق بين المتفاعلات والنواتج.
الحل:
المتفاعلات هي المواد التي يحدث لها تغيير فتتحد أو يعاد ترتبها أو تنفك وتوجد في يسار المعادلة الكيميائية أما النتائج فهي المواد الناتجة من التفاعل الكيميائي وتوجد في یمین المعادلة الكيميائية.
.64 اکتب رمز العنصر الذي يمثل بالتوزيع الإلكتروني لكل مما يأتي:
1s², 2s² 2p1 .a
1s2, 2s2 2p6, 3s² 3p1 .b
1s2, 2s2 2p6, 3s² 3p6, 4s1 3d10 .c
1s2, 2s2 2p6, 3s2 3p6, 4s2 3d2 .d
الحل:
a. B5
b. Al13
c. Cu29
d. Ti22
65. اكتب التوزيع الإلكتروني لكل عنصر ما يأتي:
Kr .a
Mg .b
Co .c
C .d
الحل:
A. Kr36: 1S2, 2S² 2P6, 3S² 3P6, 4S² 3d10, 4P6
B. Mg12: 1S2, 2S² 2P6, 3S²
C. Co27: 1S2, 2S² 2P6, 3S² 3P6, 4S², 3d7
D. C6: 1S2, 2S2 2P2
66. اكتب الصيغة الكيميائية لكل ما يأتي:
a. أكسيد الحديد II.
b. هيدروكسيد الكالسيوم.
c. نترات الرصاص II
d. كبريتيد الهيدروجين.
الحل:
a. FeO
b. Ca (OH)2
c. Pb (NO3)2
d. H2S
67. هل يشير تحـول مادة إلى مادة جديدة دائها إلى حدوث تفاعل كيميائي؟ فسّر إجابتك.
الحل:
في معظم الأحيان تغير المادة إلى مادة جديد يعد تغير كيميائي و لكن في بعض الأحیان يكون تحول نووي أو تحول بيولوجي.
68. حـدَد المتفاعلات في التفاعل الآتي: عند إضافة البوتاسـيوم إلى محلــول نـترات الخارصـين، يتكــون الخارصين ومحلول نترات البوتاسيوم.
الحل:
المتفاعلات هي المادة التي تدخل في التفاعل الكيميائي ويحدث لها تغيير وهما البوتاسيوم ومحلول نترات الخارصين.
69. زن المعادلة الكيميائية الآتية:
H2S (g) + O2(g) → SO2(g)+H2O (g)
الحل:
2H2S + 3O2 →2SO2 + 2H2O
70. اكتب معادلات لفظية للمعادلات الكيميائية الآتية:
A. Cu(s) + O 2(g) → CUO (s)
B. K(s)+ H2O(I) → KOH (aq) + H2(g)
C. CaCl2(aq) +Na2SO4(aq) → CaSO4(s) +NaCl (aq)
الحل:
A. يتفاعل فلز النحاس مع غاز الأكسجين ليكون راسب من اكسيد النحاس.
B. يتفاعل البوتاسيوم مع الماء السائل ليكون محلول هيدروكسيد البوتاسيوم ويتصاعد غاز الهيدروجين.
C. يتفاعل محلول کلوريد الكالسيوم مع محلول كبريتات الصوديوم ليكون راسب من كبريتات الكالسيوم ومحلول من ملح الطعام صوديوم كلوريد.
71. زن المعادلتين الكيميائيتين الأتيتين:
A. (NH4)2Cr2O7(s) → Cr2O3(s) + N2(g) + H2O(I)
CO 2(g) + H2O(I) → C6H12O6(s)+ O2(g) .B
الحل:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
CO2 + 6H2O → CH12O6 + 6O26
إتقان حل المسائل
72. يتحلل يوديد الهيدروجين إلى غاز الهيدروجين وغاز اليود في تفاعل تفكك. اكتب معادلة كيميائية رمزية تبين هذا التفاعل.
الحل:
2HI → H2 + l2
73. اکتب معادلات كيميائية رمزية للتفاعلات الآتية:
B. يوديد الألومنيوم (S) → ألومنيوم (S) + يود (S)
C. أكسيد الحدید III (S) →أكسيد الحدید II (S) + أكسجين (g)
→.D نترات الفضة (aq) + كبريتيد الصوديوم (aq)
كبريتيد الفضة (S) + نترات الصوديوم ((aq
الحل:
B. 2AI + 3I2 → 2AII3
C. O2 + FeO → Fe2O3
D. 2AgNO3 + Na2S → Ag2S +2NaNO3
74. اكتـب معادلة كيميائية رمزية ل لتفاعل بين الليثيوم الصلب وغاز الكلور لإنتاج كلوريد الليثيوم الصلب.
الحل:
75. اكتب معادلات کیميائية رمزية للتفاعلات الآتية، ثم
زنها:
A. → ماء (I) + ثالث أكسيد الكبريت )g)
حمض الكبريتيك (aq)
B.→ کلوريد الحدید II (aq) + ماغنسيوم
کلوريد الماغنسيوم ((aq + حدید (s)
C.→ أكسجين (g) + كلوريد النيكل II(s)
أكسيد النيكل II (s) + خماسي أكسيد ثنائي الكلور
الحل:
H2SO4→A. SO3 + H2O
B. Mg + FeCl2 → MgCl2 +Fe
NiO + Cl2O5 →C. 3O2 + NiCl
76. اكتب معادلات كيميائية رمزية للتفاعلات الآتية:
a. عند حـرق غاز البيوتـان C4H10 في الهواء ينتج ماء وغاز ثاني أكسيد الكربون.
b. يتفاعـل الماغنسيوم الصلب مع غاز النيتروجين لإنتاج نيتريد الماغنسيوم الصلب.
c. عند تسخين غاز ثاني فلوريد الأكسجين OF2 ينتج غاز الأكسجين وغاز الفلور.
الحل:
a. 2C4H10 + 13O2 → 10H2O + 8CO2
b. 3Mg +N2 → Mg3N2
c. 2OF2 → O2 + 2F2
2-4
إتقان المفاهيم
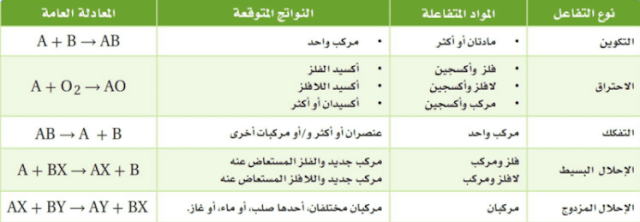
77. اذكر أنواع التفاعلات الكيميائية الأربعة، وأعط مثالاً واحدا على كل منها.
الحل:
78. ما نوع التفاعل الذي يحدث بين مادتين وينتج عنه مركب واحد؟
الحل:
تفاعل تكوين.
79. في كل مـن الأزواج الآتية، أي فلز يحل محل الفلز الآخر في تفاعلات الإحلال؟ (استعن بسلسلة النشاط).
a. القصدير والصوديوم
b. الرصاص والفضة
c. الفلور واليود
d. النحـاس والنيكل
الحل:
يحل الصوديوم محل القصدير في محلول ملحه.
يحل الرصاص محل الفضة في محلول ملحه.
يحل الفلور محل اليود في محلول ملحه.
يحل النيكل محل النحاس في محلول ملحه.
إتقان حل المسائل
80. صنف التفاعلات الواردة في السؤال 73.
الحل:
1. تفاعل تفكك (تفكك كربونات الصوديوم إلي ثاني أكسيد الكربون وأكسيد الصوديوم)
2. تفاعل تكوين (اتحاد اليود والألومنيوم لتكوين يوديد الألومنيوم)
3. تفاعل احتراق (اتحاد الأكسجين مع اكسيد الحديد)
4. احلال مزدوج
82. اكتب معادلة كيميائية رمزية موزونة لتفاعل احتراق الميثانول السائل CH3OH.
الحل:
83. اکتـب معادلات كيميائية رمزية موزونة لكل من تفاعلات التكوين الآتية:
a. → بورون + فلور.
b. → جرمانيوم + كبريت.
c. → كالسيوم + نيتروجين.
الحل:
84. الاحتراق اكتب معادلة كيميائية رمزية موزونة لاحتراق كل من المواد الآتية:
a. الباريوم الصلب.
b. البورون الصلب.
c. الأسيتون السائل C3H6O.
e. الأوكتان السائل C8H18
الحل:
85. اکتب معادلات كيميائية موزونه لتفاعلات التفكك الآتية:
a. → بروميد الماغنسيوم
b. → أكسيد الكوبلت II
c. → كربونات الباريوم
الحل:
86. اکتب معادلات كيميائية رمزية موزونة لتفاعلات الإحلال البسيط الآتية التي تحدث في الماء. (وإذا لم يحدث تفاعل فاكتب لا يحدث تفاعل (NR) في مكان النواتج).
a. → كلوريد الماغنسيوم + نيكل
b. → بروميد النحاسII + كالسيوم
c. → نترات الفضة + ماغنسيوم
الحل:
a. لا يحدث تفاعل لأن النيكل لا يحل محل الماغنسيوم لأن الماغنسيوم أنشط من طبقا لسلسة النشاط الكیمیائي.
87. أكمل المعادلة اللفظية الآتية:
→ مذاب + مذيب
الحل:
مذيب + مذاب ← محلول (مخلوط متجانس).
88. ما أنـواع النواتج المألوفة للتفاعلات التي تحدث في المحاليل المائية؟
الحل:
نواتج التفاعل في المحاليل المائية أما راسب أو غاز أو ماء.
89. قارن بين المعادلات الكيميائية الرمزية الموزونة والمعادلات الأيونية.
الحل:
المعادلة الموزونة تكتب فيها المتفاعلات والنتائج في شكل مركبات وتكون متوازنة أي عدد ذرات النواتج = عدد ذرات المتفاعلات، من نفس العنصر أما المعادلة الأيونية يُكتب فيها كل الأيونات الموجودة في التفاعل حتی الأيونات المتفرجة (المتفاعلات والنتائج المتأينة في شكل أيونات).
90. ما المعادلة الأيونية النهائية؟ وفيم تختلف عن المعادلة الأيونية الكاملة؟
الحل:
المعادلة الأيونية الكاملة يكتب فيها كل الأيونات الموجودة في التفاعل حتى الأيونات المتفرجة أما المعادلة الأيونية النهائية يكون فيها فقط الأيونات التی شاركت في التفاعل بدون الأيونات المتفرجة.
91. ما المقصود بالأيون المتفرج؟
الحل:
هي أيونات داخل التفاعل الكيميائي، ولكنها لم تشارك فيه ويتم شطبها من المعادلة الأيونية النهائية.
92. أكمل المعادلات الكيميائية الآتية:
الحل:
93. اکتـب المعادلات الأيونية الكاملة والأيونية النهائية لكل من التفاعلات الآتية:
الحل:
عند حل هذه المسألة يجب ملاحظة نوع المادة الناتجة سواء راسب أم غاز، أم ماء، أم محلول لكتابة المعادلة النهائية بشكل صحيح حيث أن الماء و الصلب و الغاز يظل كما هو و لا يكون أيونات متفرجة.
a. المعادلة الأيونية الكاملة:
المعادلة الأيونية النهائية (نكتب الماء فقط لان باقي الأيونات متفرجة):
b. المعادلة الأيونية الكاملة:
المعادلة الأيونية النهائية:
c. المعادلة الأيونية الكاملة:
المعادلة الأيونية النهائية (نكتب الغاز فقط):
d. المعادلة الأيونية الكاملة:
المعادلة الأيونية النهائية (نكتب الماء فقط الباقي أيونات متفرجة):
مراجعة عامة
94. توقع هل كل من التفاعلات الآتية يحدث في المحاليل المائيـة. ) إذا توقعـت أن التفاعل لا يحدث فاكتب: لا يحدث تفاعل (NR). ملاحظة: كبريتات الباريوم وبروميد الفضة يترسبان في المحاليل المائية).
الحل:
95. تكون راسب إضافة حمض الهيدروكلوريك إلى كأسين، إحداهما فيها محلول كلوريـد الصوديوم، وفي الأخری محلول نترات الفضة يؤدي إلى ترسب مادة بيضاء في إحدى الكأسين.
a. أي الكأسين تحتوي على راسب؟
b. ما الراسب؟
c. اکتب معادلة كيميائية توضح التفاعل.
d. صنف هذا التفاعل.
الحل:
a. الكأس الذي يحتوي على نترات الفضة
b. راسب أبيض من كلوريد الفضة
d. تفاعل احلال مزدوج.
96. ميز بين مركب أيوني ومركب تساهمي مذابين في الماء. وهل تتأين المواد التساهمية جميعها عند إذابتها في الماء؟ فسر إجابتك.
الحل:
المركب الأيوني عندما يذوب في الماء يكون أيونات موجبة وأيونات سالبة منفصلين عن بعضهما فيما تُسمی عملية التفكك أما المركبات التساهمية الجزيئية فهي مركبات تذوب على هيئة أيونات ويسمى التأين (الجزيء التساهمي فقط الذي يذوب على هيئة أيونات).
97. طبق صف التفاعل بين محلولي كبريتيد الصوديوم وكبريتات النحاس II الذي يؤدي إلى إنتاج راسب من كبريتيد النحاس II.
الحل:
هو تفاعل مائي يحدث فيه تكون راسب ويكون تفاعل احلال مزدوج حيث تتبادل الأيونات السالبة موقعها.
المعادلة Na2S + CuSO4 → CuS + Na2SO4
98. توقع وضعت قطعة من فلز الألومنيـوم في محلول KCl المائي، ووضعت قطعة أخرى مـن الألومنيوم في محلول AgNO3 المائي. هل يحدث تفاعل في كلتا الحالتين؟ لماذا؟
الحل:
عندما نضع الألومنيوم في محلول سيانيد البوتاسيوم لا يحدث تفاعل لأن الألومنيوم لا يحل محل البوتاسيوم لأن البوتاسيوم أنشط منه طبقا لسلسه النشاط الكيميائي أما عند وضع الألومنيوم في نترات الفضة يحدث تفاعل و يحل الألومنيوم محل الفضة لأن الألومنيوم أنشط من الفضة.
99. طبَـق اكتـب المعادلــة الكيميائيـة الرمزية الموزونة والأيونيـة النهائيـة لـكل مـن التفاعـلات الآتية. (إذا كان لا يحـدث تفاعـل فاکتـب NR في مكان النواتج). علما أن فوسـفات الماغنسـيوم تترسب في المحلول المائي.
الحل:
a. المعادلة الموزونة
CSNO3+ KCI → CsCl + 3KNO
المعادلة الأيونية النهائية
CsNO → Cs+ + NO3-
b. المعادلة الموزونة
المعادلة الأيونية النهائية
c. المعادلة الموزونة
المعادلة الأيونية
(يتصاعد غاز كبريتيد الهيدروجين)
مسألة تحفيز
100. يحدث تفاعل إحلال بسیط عند تفاعل النحاس مع نترات الفضة. إذا تفاعـل g 63.5 من النحاس من نترات الفضة ونتج g 215.8 من الفضة، فاکتب معــادلــة کیميائيـة رمزیة موزونة للتفاعـل. مـا الناتج الآخـر في هـذا التفاعل؟ وما مع g 339.8 كتلته؟
الحل:
تفاعل احلال فلز محل فلز آخر في محلول ملحه. ويتكون 2 مول من الفضة وكتلته 215.8 جم، يمكن تحديد الكتلة الذرية لمجموعة النترات من خلال كتلة المركب كله - كتلة الفضة.
كتلة النترات = 339.8 – 215.8 = 124
كتلة 2 مول = 124 جم
كتلة نترات النحاس = 124 + 63.5 = 187.5 جم.
101. ميز بين المخلوط والمحلول والمركب.
الحل:
المخلوط ينتج من عدة أشیاء يتم مزجهم مع بعض مثل مخلوط الرمل مع الملح ولا يحدث بينهما تفاعل كيميائي.
المحلول هو مخلوط متجانس ينتج من خلط مادة صلبة (مذاب) مع مادة سائلة (مذیب) وتذوب فيه مثل ذوبان السكر في الماء.
المركب هو مادة ناتجة من تغير كيميائي لمادة أو مادتين أو أكثر ولا يمكن رجوعها مثل السابق إلا بطرق معقدة
102. استعن بالجدول 10-4 لحساب الكتلة الذرية لعنصر الكروم.
الحل:
الكتلة الذرية للكروم = متوسط كتلة النظائر.
اسهام كل عنصر = كتلة العنصر × نسبته
اسهام الكروم - 50 = 49,946 × 0,0435 = 2,1726
اسهام الكروم - 52 = 51,941 × 0,8349 = 43,5213
اسهام الكروم - 53 = 52,941 × 0,095 = 5,0293
اسهام الكروم - 54 = 53,939 × 0,0236 = 1,2729
الكتلة الذرية للكروم = 1,2729 + 5,0293 + 43,5213 +2,1726
= 51,9961 amu
103. كيمياء المطبخ اعمل ملصقا يصف التفاعلات. الكيميائية التي تحدث في المطبخ.
الحل:
في المطبخ يوجد الكثير من التفاعلات الكيميائية فعمل الطعام مثل المخبوزات ما هو إلا تفاعل كيميائي في وجود الحرارة وصودا الخبز و العجين.
104. وزن المعادلات أعمل لوحة تصف فيها خطوات وزن المعادلة الكيميائية.
الحل:
العمل معادلة كيميائية موزونة يجب معرفة المتفاعلات والنتائج ومعرفة كل رمز لهما. نحدد أعداد التأكسد لكل عنصر في التفاعل، ويجب الأخذ في الاعتبار عدد ذرات العناصر الداخلة في التفاعل تساوي عدد ذرات العناصر الناتجة من التفاعل.
أكمل المعادلات الآتية باستخدام قواعـد الذائبية الواردة في الجدول أعلاه. وبيُن هل يتكون راسـب أم لا، وحدده. (وإذا كان لا يحدث تفاعل فاكتب NR):
الحل:
نترات الصوديوم ذائبة لأن كل النترات ذائبة، كربونات الكالسيوم لا يذوب في الماء لأن مرتبط بأیون موجب من المجموعة الثانية.
الحل:
لا يحدث تفاعل لأن الماغنسيوم لا يحل محل الصوديوم لأن الصوديوم أنشط من الماغنسيوم.
الحل:
Pb (NO3)2 + Li2s →PbS(s) + LiNO3 (aq) كبريتيد الليثيوم ذائب لأن الليثيوم من المجموعة الأولى، نترات الرصاص ذائبة لأن كل النترات ذائبة.
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"
بالتوفيق للجميع...^-^












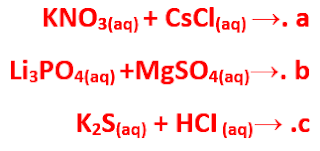














ليست هناك تعليقات:
إرسال تعليق