بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله تعالى وبركاته
حل أسئلة الفصل الأول - الإلكترونات في الذرات
نبدأ على بركة الله ...
1-1
إتقان حل المسائل
34. عرف المصطلحات الآتية:
a. التردد
b. الطول الموجي
c. الكم
d. الحالة المستقرة
الحل:
a. التردد: عبارة عن عدد الموجات التي تمر عبر نقطة معينة في الثانية الواحدة قياسها الهرتز.
b. الطول الموجي: هو أقصر مسافة بين قمتين متتاليتين أو قاعدتين متتاليتين في الموجة المستعرضة.
c. الكم: عبارة عن أقل كمية من الطاقة يمكن أن تحصل عليها الذرة أو تفقدها.
d. الحالة المستقرة: عبارة عن الحالة التي يكون فيها إلكترون الذرة عند أقل طاقة ممكنة.
35. رتب الأنواع الآتية من الإشعاعات الكهرومغناطيسية تصاعديا حسب الطول الموجي:
a. الضوء فوق البنفسجي
b. موجات الراديو
c. الميكروويف
d. الأشعة السينية
الحل:
الأشعة السينية الأقل في الطول الموجي والأكبر في التردد - الضوء فوق البنفسجي - الميكروويف - موجات الراديو هي الأكبر في الطول الموجي.
36. ما الذي تعنيه عبارة "أشعة جاما لها تردد × 1021 Hz2.88 "؟
الحل:
هذا يعني أن 1021 × 2.88 موجة من أشعة جاما تعبر نقطة معينة في الثانية.
37. ما المقصود بالتأثير الكهروضوئي؟
الحل:
هي ظاهرة انبعاث الإلكترونات المسماة بالفوتو إلكترونات من سطح الفلز عندما يسقط عليه الضوء له تردد مساوي لتردد إلكترون الفلز أو أكبر منه ويزداد عدد الإلكترونات المنبعثة بزيادة شدة الضوء وعندما تزداد طاقة الضوء تزداد طاقة الإلكترونات المنبعثة ولا يتم تحرر لأي إلكترون من سطح الفلز عندما يكون تردد الضوء أقل من تردد الإلكترون.
38. مصباح النيون كيف يختلف الضوء المنبعث من مصباح نيون عن ضوء الشمس؟
الحل:
مصباح النيون يصدر نوع معين من الأشعة فوق البنفسجية نتيجة الفوتو الكترون المبعث من الطيف الذري أما ضوء الشمس فهو مجموعة من سبعة ألوان يمكن تحللها وهي مصدر طبيعي للضوء.
2-1
إتقان حل المسائل
39. وضح مفهوم بلانك للكم من حيث علاقته باكتساب المادة للطاقة أو فقدها.
الحل:
للمادة قدرة على فقد أو كسب مقدار محدد من الطاقة ويسمى الكم، ويمكن أن تكون الكمية مضاعفة لكمية الطاقة.
40. كيف وضح أينشتاين التأثير الكهروضوئي؟
الحل:
قام أينشتاين بتوضيح أن الضوء مكون من فوتونات وأن طاقة هذا الفوتون تعتمد على التردد كما في مفهوم الكم في نظرية بلانك. وأن لكل فوتون طاقة معينة قادرة على إطلاق فوتو الكترون من سطح الفلز عند الاصطدام بسطح هذا الفلز.
41. قوس المطر اذكر فرقين بين الموجات الكهرومغناطيسية الحمراء والخضراء في قوس المطر.
الحل:
للموجات الحمراء طول موجة أطول وتردد أقل.
42. درجة الحرارة ماذا يحدث للضوء المنبعث من جسم ساخن ومشع كلما ازدادت درجة حرارته؟
الحل:
يتغير كلاً من التردد والطول الموجي للضوء المنبعث وبالتالي يتغير لون الضوء كلما حصل الجسم على طاقة أكبر.
43. اذكر ثلاث خصائص لم يستطع النموذج الموجي للضوء تفسيرها، بسبب طبيعتها الجسيمية.
الحل:
1. لا يوضح هذا النموذج التأثير الكهروضوئي.
2. انبعاث المادة للضوء بترددات مختلفة عند درجة حرارة مختلفة.
3. لا يقوم بتوضيح طيف الانبعاث الذري.
44. كيف تتشابه موجات الراديو والموجات فوق البنفسجية؟ وكيف تختلف؟
الحل:
كل منهما عبارة عن موجات مستعرضة كهرومغناطيسية تسير في الفراغ بسرعة الضوء، ويكون الاختلاف بينهما في الطول الموجي والتردد ( تكون موجات الراديو أطول في الطول الموجي وأقل في التردد والطاقة من الموجات فوق البنفسجية) .
إتقان حل المسائل
45. الإشعاع استخدم الشكل 19-1 لتحديد الأنواع الآتية من الإشعاع.
a. إشعاع بتردد .8.6 × 1011 s-1
b. إشعاع بطول موجي 4.2 nm
c. إشعاع بتردد 5.6 MHz
d. إشعاع ينتقل بسرعة 3.00 × 108 m/s
الحل:
a. أشعة تحت الحمراء.
b. الأشعة السينية (تردد الموجة = 4.2 × 10-9 ÷ 3 × 108)
0.71 × 1017Hz =.
c. موجات راديو.AM
d. أي موجان كهرومغناطيسية.
46. ما الطول الموجي للإشعاع الكهرومغناطيسي الذي تردده
5.00 ×1012 Hzوما نوع هذا الإشعاع؟
الحل:
نوع الإشعاع: الأشعة تحت الحمراء.
47. ما تردد الإشعاع الكهرومغناطيسي الذي طوله الموجي
3.33 ×10-8 m؟ وما نوع هذا الإشعاع؟
الحل:
نوع الإشعاع: الأشعة البنفسجية.
48. ما سرعة الموجة الكهرومغناطيسية التي ترددها
1.33 ×1017 Hz وطول موجتها 2.25 nm؟
الحل:
سرعة الموجة = التردد × الطول الموجي
=(1.33 ×1017) (2.25 ×10-9)
= 2.99 × 108 m/s
49. ما طاقة فوتون من الضوء الأخر تردده 4.48 × 1014 Hz؟
الحل:
50. الزئبق يظهر في الشكل 20 طيف الانبعاث الذري للزئبق. قدر الطول الموجي للخط البرتقالي. ما تردده؟ وما طاقة الفوتون لهذا الخط المنبعث من ذرة الزئبق؟
الحل:
51. ما طاقة الفوتون فوق البنفسجي الذي طول موجته 1.18 ×10-8 m؟
الحل:
52. فوتون يمتلك طاقة مقدارها J 25-10× 2.93، فما تردده؟ وما نوع الإشعاع الكهرومغناطيسي لهذا الفوتون؟
الحل:
نوع الإشعاع موجات راديو
53. فوتون يمتلك طاقة مقدارها J 13-10 × 1.10، فما طول موجته؟ وما نوع الإشعاع الكهرومغناطيسي لهذا الفوتون؟
الحل:
نوع الإشعاع: أشعة سينية أو أشعة جاما.
54. السفينة الفضائية ما الوقت الذي تحتاج إليه إشارة الراديو من سفينة الفضاء فويجر حتى تصل الأرض إذا كانت المسافة بين فويجر والأرض 2.72 × 109 Km؟
الحل:
55. موجات الراديو إذا كانت محطة إذاعة FM تبث على تردد
104.5 MHz ، فما الطول الموجي لإشارة المحطة بالأمتار ؟ وما طاقة الفوتون لهذه المحطة؟
الحل:
56. بلاتين ما أقل تردد للضوء الذي يتطلبه إرسال فوتو إلكترون واحد من ذرات البلاتين والتي تحتاج على الأقل إلى (9.08 ×10-19 n/photon)؟
الحل:
57. جراحة العين يستخدم ليزر فلوريد الأرجون (ArF) في بعض جراحات تصحيح العين والذي يبعث إشعاعا كهرومغناطيسيا طول موجته 193.3nm فما تردد إشعاع ليزر ArF؟ وما طاقة كم واحد من هذا الإشعاع؟
الحل:
58. الهيدروجين إذا كان طول موجة خط واحد في طيف انبعاث الهيدروجين486 nm ، فاستعن بالشكل أعلاه على تحديد لون الخط وتردده؟
الحل:
لون الخط أزرق مخضر.
2-1
إتقان المفاهيم
59. اعتمادا على نموذج بور، كيف تتحرك الإلكترونات في الذرات؟
الحل:
تتحرك الإلكترونات في مستويات دائرية حول النواة.
60. ما الذي تمثله n في نموذج بور الذري؟
الحل:
تمثل n العدد الكمي الذي يحدد مستوى الإلكترون.
61. ما الفرق بين حالة الاستقرار وحالة الإثارة للذرة؟
الحل:
حالة استقرار الذرة هي الحالة الأقل طاقة، في حين أن أي حالة طاقة أعلى من حالة الاستقرار تعد حالة إثارة للذرة.
62. ما اسم النموذج الذري الذي تعامل فيه الإلكترونات على أنها موجات؟ ومن أول من كتب معادلات موجة الإلكترون التي أدت إلى هذا النموذج؟
الحل:
يسمى النموذج بالنموذج الميكانيكي الكمي للذرة للعالم شرودنجر.
63. ما المقصود بالمستوى الفرعي؟
الحل:
يقصد بالمستوى الفرعي أنه منطقة ثلاثية الأبعاد حول النواة تصف موقع الإلكترون المحتمل حول النواة وتشبه السحابة.
64. ما الذي ترمز إليه n في النموذج الميكانيكي الكمي للذرة؟
الحل:
ترمز n في النموذج الميكانيكي إلى عدد الكم الرئيسي ويشير إلى الحجم النسبي وطاقة المستوى.
65. انتقال الإلكترون اعتمادًا على نموذج بور الموضح في الشكل 22-1 ما نوع انتقالات الإلكترون التي تنتج سلاسل فوق بنفسجية في سلسلة ليمان لذرة الهيدروجين؟
الحل:
تحدث سلسلة ليمان بسبب انتقال الإلكترون من مستويات بور العالية الطاقة الى المستوى 1=n.
66. ما عدد مستويات الطاقة الثانوية في المستويات الثلاثة الرئيسة الأولى للطاقة في ذرة الهيدروجين؟
الحل:
المستوى الرئيسي الأول يحتوي على مستوى ثانوي.
المستوى الرئيسي الثاني يحتوي على 2 مستويات ثانوية.
المستوى الرئيسي الثالث يحتوي على 3 مستويات ثانوية.
67. ما عدد المستويات الفرعية في المستوى الثانوي d؟
الحل:
عدد المستويات الفرعية في المستوى الثانوي d خمسة.
68. ما وجه التشابه بين مستويات الطاقة الفرعية في مستوى الطاقة الثانوي؟
الحل:
لها نفس الشكل.
69. ما اتجاهات المستويات الفرعية الخمسة المرتبطة في المستوى الثانوي d؟
الحل:
سوف تكون اتجاه المستويات الفرعية الخمسة المرتبطة في المستوى d كالآتي:
xy, xz, yz, x2 – y2, z2.
70. ما أقصى عدد يمكن أن يسعه المستوى الفرعي من الإلكترونات؟
الحل:
الكترونان.
71. صف الاتجاهات النسبية للمستويات الفرعية المرتبطة في المستوى الثانوي 2p.
الحل:
تقع على طول محور الإحداثيات x,y,z المستويات الفرعية الثلاثة لـ p متعامدة بعضها على بعض فصية.
72. ما عدد الإلكترونات التي يمكن أن توجد في جميع المستويات الفرعية للمستوى الرئيس الثالث للطاقة في ذرة الأرجون؟
الحل:
ثمانية إلكترونات.
73. كيف يصف النموذج الميكانيكي الكمي مسار الإلكترونات في الذرة؟
الحل:
لا يعطي النموذج الكمي أي وصف لمسارات الالكترونات في الذرة.
74. لماذا يكون من المستحيل لنا أن نعرف بدقة سرعة الإلكترون - وموقعه في الوقت نفسه؟
الحل:
لصعوبة تحديد مسارات ثابتة للإلكترونات، وأن ما يمكن معرفته فقط هو المكان المحتمل وجود الالكترون فيه حول النواة.
3-1
إتقان المفاهيم
75. ما تسلسل ملء الإلكترونات في المستويات الفرعية للمستوى الثانوي؟
الحل:
يجب أن يحتوي كل مستوى على إلكترون واحد قبل دخول الكترون آخر إليه.
76. الروبيديوم وضح باستخدام الشكل 23-1، لماذا يشغل إلكترون واحد في ذرة الروبيديوم مستوى s5 بدلاً من 4d أو 4f؟
الحل:
طاقة المستوى في المستوى s5 أقل من طاقة المستويات بـ 4f و4d
77. ما إلكترونات التكافؤ؟ وكم إلكترون تكافؤ في ذرة الماغنسيوم من الإلكترونات الاثني عشر التي تحتويها؟
الحل:
هي إلكترونات مستويات الذرة الخارجية؛ عددها 2
78. إن للضوء طبيعة مزدوجة (موجة - جسيم). فماذا تعني هذه الجملة؟
الحل:
يسلك الضوء سلوكاً مشابهاً للموجة في بعض الحالات ومشابهاً للجسيمات في حالات أخرى.
79. صف الفرق بين الكم والفوتون.
الحل:
الكم: هو أقل طاقة يمكن أن تفقدها الذرة أو تكتسبها على حين أن الفوتون جسيم يحمل طاقة مقدارها كم واحد.
80. ما عدد الإلكترونات التي تظهر في التمثيل النقطي للإلكترونات لذرات العناصر الآتية؟
a. الكربون.
b. الكالسيوم.
c. اليود.
d. الجاليوم.
الحل:
a. الكترونات.
b. الكترونات.
c. الكترونين.
d. 3 الكترونات.
81. ما المبادئ الثلاثة أو القواعد التي يجب اتباعها عند كتابة التوزيع الإلكتروني لذرة عنصر ما؟
الحل:
مبدأ باولي، مبد أوفباو وقاعدة هوند.
82. اكتب التوزيع الإلكتروني لذرات الأكسجين والكبريت، بطريقة الترميز الإلكتروني.
الحل:
الأكسجين يحتوي على 8 إلكترونات ويكون توزيعها كالآتي:
O8: 1s2 2s2 2p4
وسيكون الترميز الإلكتروني لها بالشكل:
الكبريت يحتوي على 16 إلكترونات ويكون توزيعها كالآتي:
S16: 1s2 2s2 2p6 3s2 3p4
وسيكون الترميز الإلكتروني لها بالشكل:
83.اكتب تسلسل أوفباو للمستويات من 1s إلى 7p.
الحل:
سوف يكون التسلسل كالآتي:
1s, 2s,2p,3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
84.اكتب التوزيع الإلكتروني للعناصر الآتية بطريقتي الترميز الإلكتروني ورسم مربعات المستويات:
a. البيريليوم.
b. الألومنيوم.
c. النيتروجين.
d. الصوديوم.
الحل:
a. Be4: 1s2 2s2
b. Al13: 1s2 2s2 2p6 3s2 3p1
c. N7: 1s2 2s2 2p3
d. Na11: 1s2 2s2 2p6 3s1
85. استخدم ترميز الغاز النبيل لكتابة التوزيع الإلكتروني للعناصر الآتية:
a. Zr
b. Pb
c. Kr
d. P
الحل:
a. الزراكونيوم Zr توزيعه كالآتي:
Zr: [Kr] 5s2 4d2
b. الرصاص Pb توزيعه كالآتي:
Pb: [Xe] 6s2 4f14 5d10 6p2
c. الكربتون Kr توزيعه كالآتي:
Kr: [Ar] 4s2 3d10 4p6
d. الفسفور P توزيعه كالآتي:
P: [Ne] 3s2 3p3
86. حدد العنصر الذي يُمثل بالتوزيع الإلكتروني الآتي:
a. 1s2 2s2 2p5
b. [Ar] 4s2
c. [Xe] 6s2 4f4
d. [Kr] 5s2 4d10 5p4
e. [Rn] 7s2 5f13
f. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
الحل:
a. الفلور F
b. الكالسيوم Ca c
c. أندبينيوم Nd
d. تريلينيوم Te
e. Md
f. البروم Br
87. أي رسوم مربعات المستويات في الشكل 24-1 صحيحة للذرة في حالة الاستقرار؟
الحل:
88. ارسم التمثيل النقطي لإلكترونات ذرات العناصر الآتية:
a. الكربون
b. الزرنيخ
c. البولونيوم
d. البوتاسيوم
e. الباريوم
الحل:
89. ما عدد المستويات الرئيسة الموجودة في ذرة الزرنيخ؟ وما عدد المستويات الفرعية الممتلئة بصورة كاملة؟ وما عدد المستويات الفرعية في مستوى الطاقة الرئيس 4 = n؟
الحل:
أولاً نقوم بكتابة التوزيع الإلكتروني للزرنيخ:
As33: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
ثانياً نقوم بتحديد عدد المستويات الرئيسية والفرعية:
عد المستويات الرئيسية = 4
مستويات عدد المستويات الفرعية الممتلئة = 15 مستوى
عدد المستويات الفرعية في المستوى الرابع = 4 مستويات ( 3 للمستوى الفرعي P و 10 للمستوى الفرعي S ).
90. ما العنصر الذي قد يكون لذرته التمثيل النقطي للإلكترونات للحالة المستقرة والموضحة في الشكل 25-1؟
a. المنجنيز
b. الأنتيمون
c. الكالسيوم
d. الساماريوم
الحل:
b.الأنتيمون.
91. اكتب التوزيع الإلكتروني لذرة القصدير في الحالة المستقرة، باستخدام ترميز الغاز النبيل، وارسم تمثيلها النقطي للإلكترونات.
الحل:
التوزيع الإلكتروني سوف يكون
Sn50: [Kr] 5s2 4d10 5p2
القصدير يحتوي على أربعة إلكترونات في المستوى الخارجي.
التمثيل النقطي سوف يكون بالشكل
92. ما أقصى عدد من الإلكترونات يمكن أن يوجد في مستويات الطاقة في الذرات التي لديها أعداد الكم الرئيسة الآتية:
a. 3
b. 4
c. 6
d. 7
الحل:
نقوم بتطبيق قاعدة عدد الإلكترونات = 2n2
a. 2 × 32 = 18.
b. .2 × 42 = 32
c. .2 × 62 = 72
d. .2 × 72 = 98
93. ما عدد الاتجاهات المحتملة للمستويات الفرعية المتعلقة في كل مستوى ثانوي مما يأتي:
a. s
b. P
c. d
d. f
الحل:
a. المستوى s له اتجاه واحد.
b. المستوى p له 3 اتجاهات.
c. المستوى d له 5 اتجاهات.
d. المستوى f له 7 اتجاهات.
94. أي العناصر الآتية لديها إلكترونان فقط في تمثيلها النقطي: الهيدروجين، الهيليوم، الليثيوم، الألومنيوم، الكالسيوم، الكوبالت البروم، الكربتون، الباريوم؟
الحل:
الهيليوم، الكالسيوم، الكوبالت، الباريوم.
95. أي انتقال للإلكترون عبر المدارات ينتج خطا أخضر - أزرق في طيف الانبعاث الذري للهيدروجين حسب نموذج بور للذرة؟
الحل:
من انتقال الإلكترون من المستوى الرابع إلى المستوى الثاني. أي
n=4→ n=2
96. الخارصين: تحتوي ذرة الخارصين على 18 إلكتروناً في المستويات 3s و 3p و3d. فلماذا يظهر في تمثيلها النقطي للإلكترونات نقطتان فقط ؟
الحل:
النقطتان هما الكترونا تكافؤ المستوى s4 في الذرة.
97. أي عنصر له التوزيع الإلكتروني الممثل بترميز الغاز
النبيل [Rn] 7s1؟
الحل:
الفرانسيوم.
98. كيف وضح بور طيف الانبعاث الذري؟
الحل:
اقترح بور أن الذرات تبعث ضوء بأطوال موجية وطاقات معينة عندما تنتقل الإلكترونات من مستويات طاقة عالية إلى مستويات طاقة منخفضة.
التفكير الناقد
99. صف أشكال المستويات الفرعية الموضحة في الشكل 26-1، وحدد اتجاهاتها.
الحل:
المستوى s: كروي الشكل.
المستوى p: في صورة موجبة على طول المحور y.
المستوى d: في صورة فصين متعامدين يقعان في مستوى xy.
100. استنتج تخيل أنك تعيش في عالم ينص فيه مبدأ باولي على أن ثلاثة إلكترونات على الأكثر، وليس اثنين، قد تكون في كل مستوى طاقة فرعي. اشرح الخواص الكيميائية الجديدة لعناصر الليثيوم والفوسفور.
الحل:
كلاً من الليثيوم والفسفور يصبح غاز نبيل، لليثيوم توزيع الكتروني 1s3 ويكون متشبهاً للهيليوم1s2، الفسفور له التوزيع الالكتروني 1s3 2s3 2p9 وبذلك يكون متشابه للنيون 1s2 2s2 2p6.
مراجعة تراكمية
101. حدد ما إذا كانت كل جملة تصف خاصية كيميائية أو خاصية
فيزيائية.
a. الزئبق سائل عند درجة حرارة الغرفة.
b. السكروز صلب أبيض بلوري.
c. يصدأ الحديد عندما يتعرض للهواء الرطب.
d. يحترق الورق عندما يشتعل.
الحل:
a. خواص فيزيائية.
b. خواص فيزيائية.
c. خواص كيميائية.
d. خواص كيميائية.
102. إذا كان العدد الذري لذرة الجادولينيوم 64، وعددها الكتلي 153 في عدد كل من الإلكترونات والبروتونات والنيوترونات التي توجد فيها؟
الحل:
العدد الذري = 64 إلكترون و64 بروتون.
عدد النيوترونات = 153 - 64 = 89 نيوترون.
تقويم إضافي
الكتابة في الكيمياء
103. لوحات النيون لعمل لوحات نيون تبعث ألوانا مختلفة، يملأ المصنعون اللوحات بغازات غير النيون. اكتب مقالة تعبر فيها عن استخدام الغازات في لوحات النيون والألوان التي تنتجها تلك الغازات.
الحل:
استخدام الغازات في لوحات النيون والألوان التي تنتجها:
لوحات النيون هي نوع من الإضاءة المميزة التي تستخدم الغازات لإنتاج أضواء ملونة. على الرغم من أن النيون هو الغاز الأكثر شهرة المستخدم في هذه اللوحات، إلا أن المصنعين يستخدمون مجموعة متنوعة من الغازات الأخرى لإنتاج ألوان مختلفة.
أهم الغازات المستخدمة في لوحات النيون هي:
1. النيون (Neon): ينتج لون أحمر متوهج عند تعريضه للتيار الكهربائي.
2. الهليوم (Helium): ينتج لون أصفر عند تعريضه للتيار الكهربائي.
3. الأرجون (Argon): ينتج لون أزرق متوهج عند تعريضه للتيار الكهربائي.
4. الكريبتون (Krypton): ينتج لون أبيض مائل إلى الأزرق عند تعريضه للتيار الكهربائي.
5. الزينون (Xenon): ينتج لون أبيض مائل إلى الأزرق عند تعريضه للتيار الكهربائي.
6. الهيدروجين (Hydrogen): ينتج لون وردي عند تعريضه للتيار الكهربائي.
باستخدام مزيج من هذه الغازات، يمكن للمصنعين إنتاج طيف واسع من الألوان في لوحات النيون، بما في ذلك الأحمر والأخضر، والأزرق، والأرجواني، والأبيض. هذا التنوع في الألوان يسمح للمصممين والفنانين بالتعبير الإبداعي والابتكار في تصميم لوحات النيون المميزة.
يستمر استخدام لوحات النيون في التألق كوسيلة إضاءة فنية وديكورية في العديد من المجالات مثل الإعلان، والتسويق، والترفيه، والفن. وبفضل التقدم التكنولوجي، أصبحت هذه اللوحات أكثر كفاءة وأقل استهلاكًا للطاقة، مما يجعلها خيارًا جذابًا للعديد من التطبيقات الحديثة.
104. نموذج رذرفورد: تخيل أنك عالم في أوائل القرن العشرين، وقد علمت بتفاصيل النموذج الذري الجديد المقترح من الفيزيائي البريطاني أرنست رذرفورد. بعد تحليلك لهذا النموذج وضح أهم نقاط الضعف التي تعتقد أنه يتضمنها، ثم اكتب رسالة موجهة إلى رذرفورد تعبر فيها عن اهتمامك بنموذجه، مستخدما رسوما وأمثلة على عناصر محددة لمساعدتك على إظهار وجهة نظرك.
الحل:
بسم الله الرحمن الرحيم
النموذج الذري لرذرفورد: رؤية وتساؤلات من عالم في أوائل القرن العشرين
عزيزي البروفيسور رذرفورد،
لقد كان اقتراحك الجديد لنموذج الذرة موضع اهتمام واهتمام كبير في مجتمع العلماء. أنا سعيد بفرصة مناقشة هذا النموذج معك وتقديم بعض ملاحظاتي عليه.
أوًلا، أود أن أشيد بإنجازك في إجراء تجربة قصف جسيمات ألفا على رقائق رقيقة من الذهب، والتي أدت إلى اكتشاف نواة الذرة. هذه خطوة مهمة في فهم البناء الداخلي للذرة وتجاوز النموذج السابق للذرة ككرة صلبة.
أبرز نقاط القوة في نموذجك تتمثل في:
1) تفسير انحراف جسيمات ألفا عند مرورها بالذرة، حيث يشير ذلك إلى وجود نواة مركزية.
2) تحديد حجم النواة الذري والذي يعتبر صغيرًا جدًا مقارنة بحجم الذرة ككل.
3) اقتراح أن الإلكترونات تدور حول النواة في مدارات محددة.
ومع ذلك، لدي بعض التساؤلات والملاحظات حول جوانب معينة في نموذجك:
1) كيف يمكن للإلكترونات أن تدور حول النواة دون أن تفقد طاقتها وتنهار إلى النواة؟ هذا يتعارض مع المفاهيم الفيزيائية المعروفة حتى الآن.
2) هل النواة مكونة فقط من بروتونات، أم أن هناك جسيمات أخرى موجودة فيها؟ إذا كانت هناك جسيمات أخرى، فما هي وكيف تؤثر على ثبات الذرة؟
3) كيف يمكن تفسير طيف الانبعاث الذري في ظل نموذجك؟ فالطيف الخطي لا يتوافق مع فكرة المدارات الدائرية المحددة.
لعل هذه التساؤلات ستكون موضع اهتمام وبحث لك ولزملائك في المستقبل. أنا أتطلع إلى رؤية كيف سيتطور نموذج الذرة في ضوء هذه الملاحظات.
أرفق بهذه الرسالة بعض الرسومات التوضيحية لبعض النقاط التي ناقشتها، آملًا أن تساعدك في فهم وجهة نظري.
تقبل فائق احترامي وتقديري لجهودك العلمية.
أسئلة المستندات
عند تبخر فلز الصوديوم في أنبوب التفريغ ينتج خطان متقاربان، أحدهما أصفر والأخر برتقالي. ولأن أنابيب بخار الصوديوم فعالة كهربائيا فإنها تستخدم على نطاق واسع في الإضاءة خارج المنازل، كما في إنارة الشوارع، وأضواء (التحذير) الأمن. يبين الشكل 27 – 1 الطيف المرئي وطيف الانبعاث للصوديوم.
105. ما الفرق بين الطيفين في الشكل أعلاه؟
الحل:
إحدى الطبقات توضح جميع ألوان الطيف المرئي أما الطبقة الأخرى يوضح ألواناً محددة تكون منبعثة من ذرات الصوديوم Na ويعرف بطيف الانبعاث الذري للصوديوم Na
106. يشع الصوديوم خطين طولاهما 588.9590 nm و
589.9524 nm على الترتيب. اكتب التوزيع الإلكتروني الأكثر استقرارا للصوديوم. ما علاقة التوزيع الإلكتروني للصوديوم بالخطوط؟
الحل:
التوزيع الإلكتروني سوف يكون بالشكل التالي:
1s2 2s2 2p6 3s1
ويظهر الخطان عندما تنتقل ذرات الصوديوم من حالة أكثر إثارة تكون فيها الطاقة أعلى إلى حالة أقل طاقة وهذا يحدث عندما تنتقل الإلكترونات من مستويات طاقة أعلى إلى مستوى طاقة أقل.
107. احسب طاقات الفوتونات المرتبطة بالخطين، مستخدمًا المعادلات E=hc/λ , c = λν ,E = h/ν.
الحل:
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"
بالتوفيق للجميع...^-^




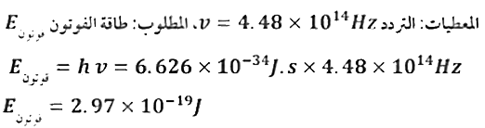































ليست هناك تعليقات:
إرسال تعليق