بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله تعالى وبركاته
حل أسئلة الفصل الثاني - الجدول الدوري والتدرج في خواص العناصر
نبدأ على بركة الله ...
1-2
إتقان المفاهيم
25. ما النقص في الجدول الدوري لمندليف؟
الحل:
لم يكن جدول مندليف صحيح تماماً واستعمل الكتل الذرية بدلاً من العدد الذري لترتيب العناصر مما نتج عن ذلك وضع بعض العناصر في المكان الخاطئ.
26. وضح كيف ساهمت قاعدة الثمانيات لنيولاندز في تطور الجدول الدوري؟
الحل:
قاعدة الثمانيات هي ترتيب العناصر تبعاً للكتل الذرية لكل ثمانية عناصر وبعد مرور السنوات وجد أنه على صواب وأن خواص العناصر تتكرر بشكل دوري كل ثمانية عناصر.
27. أعد كل من لوثر ماير وديمتري مندليف جداول دورية متشابهة في عام 1869م. فلماذا حظي مندليف بسمعة أكبر بالجدول الدوري الذي أعده؟
الحل:
لأن مندليف قام بنشر دراسته أولاً قبل ماير إضافة إلى أنه وضح عدد أكبر من الخواص الدورية.
28. ما المقصود بتدرج خواص العناصر؟
الحل:
هو تكرار الخواص الكيميائية والفيزيائية عند ترتيب العناصر تصاعدياً وفق أعدادها الذرية.
29. صف الخواص العامة للفلزات.
الحل:
الفلزات مواد صلبة عادة ملساء لامعة ولها بريق معدني وجيدة التوصيل للحرارة، والكهرباء، وقابلة للطرق، والسحب.
30. ما الخواص العامة لأشباه الفلزات؟
الحل:
أشباه الفلزات لها خواص كيميائية وفيزيائية مشتركة بين الفلزات واللافلزات ولها استخدامات مهمة في الصناعة.
31. صنّف العناصر الآتية إلى فلزات أو لافلزات أو أشباه فلزات.
a. الأكسجين O.
b. الباريوم Ba.
c. الجرمانيوم .Ge
d. الحديد Fe.
الحل:
a. لافلز
b. فلز
c. شبة فلز
d. فلز
32. صل كل بند في العمود الأيمن بما يناسبه من المجموعات في العمود الأيسر:
|
a. العناصر القلوية |
1. المجموعة 18 |
|
b. الهالوجينات |
2. المجموعة 1 |
|
c. العناصر القلوية الأرضية |
3. المجموعة 2 |
|
d. الغازات النبيلة |
4. المجموعة 17 |
|
|
5. المجموعة 15 |
الحل:
|
a. العناصر القلوية |
المجموعة 1 |
|
b. الهالوجينات |
المجموعة 15 |
|
c. العناصر القلوية الأرضية |
المجموعة 2 |
|
d. الغازات النبيلة |
المجموعة 18 |
33. ارسم مخططا بسيطا للجدول الدوري، وحدد عليه مواقع كل من الفلزات القلوية والفلزات القلوية الأرضية والعناصر الانتقالية والعناصر الانتقالية الداخلية والغازات النبيلة والهالوجينات، باستخدام الملصقات.
الحل:
تم التصنيف حسب اللون.
34 وضح ما يشير إليه الخط الداكن في منتصف الشكل 19-2.
الحل:
يشير السهم إلى المكان الذي يجب أن توضع فيه العناصر، ولكن تم وضعها في أسفل الجدول وذلك لتوفير المكان.
35. ما الرمز الكيميائي لكل من العناصر الآتية؟
a. فلز يستخدم في مقياس الحرارة.
b. غاز مشع يستخدم للتنبؤ بحدوث هزات أرضية، وهو غاز نبيل له أكبر كتلة ذرية مقارنة بعناصر مجموعته.
c. يستخدم لطلاء علب المواد الغذائية، وهو فلز له أقل كتلة ذرية في المجموعة 14.
d. عنصر انتقالي يستخدم في صناعة الخزائن، ويقع في المجموعة 12 في الجدول الدوري.
الحل:
a. الزئبق Hg
b. الرادون Rn
c. القصدير Sn
d. النيون Ni
36. إذا اكتشف عنصر جديد من الهالوجينات وآخر من الغازات النبيلة فما العدد الذري لكل منهما؟
الحل:
العدد الذري للهالوجين الجديد = 117
العدد الذري للغاز النبيل الجديد = 118
إتقان حل المسائل
37. لو رتبت العناصر وفق كتلها الذرية فأي العناصر الـ 55 الأولى يكون ترتيبها مختلفًا عما هو عليه في الجدول الدوري الحالي؟
الحل:
يجب أن يحل (الأرجون والبوتاسيوم) أحدهما مكان الآخر في الجدول الدوري، ويحل (الكوبالت والنيكل) أحدهما مكان الآخر ويحل (التيليريوم واليود) أن يحل أحدهما مكان الآخر.
38. عنصر ثقيل جديد لو اكتشف العلماء عنصرا يحتوي على 117 بروتونا، فما المجموعة والدورة التي ينتمي إليهما؟ وهل يكون فلزاً أو لا فلزاً أو شبه فلز؟
الحل:
يكون العدد الذري = 117 ويقع في المجموعة 17 في الهالوجينات وفي الدورة السابعة، يكون شبه فلز.
39. ما الرمز الكيميائي للعنصر الذي ينطبق عليه الوصف الآتي؟
a. عنصر في الدورة 3 يمكن استخدامه في صناعة رقائق الحاسوب لأنه شبه فلز.
b. عنصر في المجموعة 13 والدورة 5 يستخدم في صناعة الشاشات المسطحة في أجهزة التلفاز.
c. عنصر يستخدم فتيلا في المصابيح، وله أكبر كتلة ذرية بين العناصر الطبيعية في المجموعة 6.
الحل:
a- السيليكون Si
b- الأنديوم In
c- التنجستين W
2-2
إتقان المفاهيم
40. المنتجات المنزلية ما أوجه الشبه في الخواص الكيميائية بين الكلور الذي يستخدم في تبييض الملابس واليود الذي يضاف إلى ملح الطعام؟ فسر إجابتك.
الحل:
كلاً من اليود والكلور من الهالوجينات ويقعا في المجموعة 17 ولها توزيع إلكترونات التكافؤ نفسه s2p5.
41. ما علاقة رقم مستوى طاقة إلكترون التكافؤ برقم دورة العنصر في الجدول الدوري؟
الحل:
رقم مستوى طاقة إلكترون التكافؤ هو رقم الدورة لهذا العنصر في الجدول الدوري، فمثلاً عندما يقع إلكترون التكافؤ في مستوى الطاقة الثالث يكون العنصر يقع في الدورة الثالثة.
42. ما عدد إلكترونات تكافؤ كل عنصر من الغازات النبيلة؟
الحل:
عدد إلكترونات التكافؤ في الغازات النبيلة هي 8 إلكترونات ماعدا الهيليوم فهي تحتوي على إلكترونين فقط.
43. ما الفئات الأربع الرئيسة في الجدول الدوري؟
الحل:
عناصر الفئة s، عناصر الفئة p، عناصر الفئة d، عناصر الفئة f.
44. ما التوزيع الإلكتروني الأكثر استقرارًا؟
الحل:
هي توزيع الغازات النبيلة عندما يكون المستوى الفرعي ممتلئ، أو التوزيع الذي يكون فيه المستوى الفرعي فارغ أو نصف ممتلئ.
45. فسر كيف يمكن أن يحدد توزيع إلكترونات التكافؤ موقع الذرة في الجدول الدوري؟
الحل:
إلكترونات التكافؤ تحدد رقم المجموعة فعندما يحتوي المستوى الأخير على إلكترون واحد فهو يقع في المجموعة الأولى كما أن عدد مستوى الطاقة الذي يوجد به إلكترونات التكافؤ يحدد رقم الدورة.
46. اكتب التوزيع الإلكتروني للعنصر الذي ينطبق عليه الوصف الآتي:
a. عنصر في المجموعة ،15، وغالبًا ما يكون جزءا من مركبات مساحيق التجميل.
b. هالوجين في الدورة 3، يدخل في تركيب منظفات الملابس، ويستخدم في صناعة الورق.
c. فلز انتقالي سائل عند درجة حرارة الغرفة، ويستخدم أحيانًا في مقاييس درجة الحرارة.
الحل:
a. النيتروجين
N7: 1s2 2s2 2s3
b. الكلور
Cl17: 1s2 2s2 2p6 3s2 3p5
c. الزئبق
Hg80: [Xe] 6s2 5d10
47. حدّد كلا من المجموعة، والدورة والفئة لكل عنصر مما يأتي:
a. [Kr] 5s2 4d1
b. [Ar] 4s2 3d10 4p3
c. [He] 2s2 2p6
d. [Ne] 3s2 3p1
الحل:
الدورة الخامسة، المجموعة 3، فئة d
الدورة الرابعة المجموعة 15، فئة p
الدورة الثانية، المجموعة 18، فئة p
الدورة الثالثة، مجموعة 13، فئة p
48. عنصران في المجموعة نفسها، فهل يكون نصف قطر ذرة العنصر الذي له عدد ذري أكبر، أصغر أم أكبر من نصف قطر ذرة العنصر الآخر؟
الحل:
العنصر الذي له عدد ذري أكبر يكون نصف قطره أكبر من العنصر الآخر.
49. يوضح الجدول 6 - 2 عدد العناصر في الدورات الخمس الأولى من الجدول الدوري. فسّر لماذا تحتوي بعض الدورات على أعداد مختلفة من العناصر؟
الحل:
لأن الجدول الدوري مقسم إلى 4 فئات تمثل مستويات الطاقة الثانوية والتي تحتوي على إلكترونات التكافؤ وكل فئة تبدأ من دورة معينة.
50. النقود تسمى إحدى مجموعات العناصر الانتقالية بمجموعة النقود؛ لأن معظم قطع النقود المعدنية تصنع من عناصر هذه المجموعة. ما رقم هذه المجموعة؟ وما العناصر التي تنتمي إليها؟ وهل ما زالت مستخدمة في صناعة النقود حتى الآن؟
الحل:
رقم المجموعة هي 11 ينتمي إليها النحاس والذهب والفضة، نعم مازالت مستخدمة وتستخدم كسبيكة مع عناصر أخرى.
51. هل توجد إلكترونات تكافؤ جميع عناصر المجموعة 17 في مستوى الطاقة الرئيس نفسه؟ فسّر إجابتك.
الحل:
لا، لأن كل هالوجين يقع في دورة مختلفة، لهذا السبب فإن إلكترونات التكافؤ توجد في مستويات فرعية تنتمي إلى مستويات طاقة مختلفة.
اتقان حل المسائل
52. أضواء الإشارة الخضراء. يُكسب فلز الباريوم الإشارة الخضراء اللون الأخضر. اكتب التوزيع الإلكتروني للباريوم وصف موقعه من حيث المجموعة والدورة والفئة في الجدول الدوري.
الحل:
الباريوم ورمزه Ba
وتوزيعه الإلكتروني هو بالشكل Ba56: [Xe] 6s2
موقعه في الدورة السادسة، المجموعة الثانية الفئة s.
53. السماعات تستخدم المغانط المصنوعة من فلز النيوديميوم في صناعة السماعات؛ لأنها قوية وخفيفة. اكتب التوزيع الإلكتروني لهذا العنصر، وأين يقع في الجدول الدوري؟
الحل:
النيوديوم ورمزه Nd
وتوزيعه الإلكتروني هو بالشكل Nd60: [Xe] 6s2 4f4
موقعه في الفئة f
54. علب الصودا التوزيع الإلكتروني للفلز المستخدم في صناعة علب الصودا هو Ne] 3s2 3p1]. ما اسم هذا الفلز؟ حدد رقم مجموعته ودورته، وفئته في الجدول الدوري.
الحل:
الفلز هو الألمنيوم ورمزه Al
موقعه في الدورة الثالثة، المجموعة 13 الفئة p
55. املأ الفراغ في الجدول 7-2.
الحل:
3-2
إتقان المفاهيم
56. ما المقصود بطاقة التأين؟
الحل:
طاقة التأين هي مقدار الطاقة اللازمة لانتزاع إلكترون واحدة من الذرة وهي في الحالة الغازية.
57. يشكل عنصر ما أيونا سالبا عند التأين. فأين يقع هذا العنصر في الجدول الدوري؟ فسر إجابتك.
الحل:
يقع هذا العنصر في الجهة اليمنى من الجدول الدوري لأنه يكتسب الإلكترونات ليصل إلى حالة الثمانية والاستقرار ويقع هذا العنصر في المجموعة 18.
58. أي العناصر الآتية: الماغنسيوم أم الكالسيوم أم الباريوم، نصف قطر أيونه أكبر؟ وأيها نصف قطر أيونه أصغر؟ وما نمط التغير الذي يفسر ذلك؟
الحل:
عند الاطلاع على الجدول الدوري نجد أن كل من الكالسيوم والباريوم والماغنسيوم يقعون في مجموعة واحدة وهي المجموعة الثانية وخلال المجموعة الواحدة يزداد نصف قطر الأيوني عند التوجه من أعلى إلى أسفل بـ زيادة عدد مستويات الطاقة الممتلئة بالإلكترونات.
59. فسر لماذا تزداد طاقة تأين العناصر المتتالية في الجدول الدوري عبر الدورة؟
الحل:
كلما اتجهنا من اليسار إلى اليمين في الجدول الدوري يزداد شحنة النواة وبالتالي زيادة قوة جذب النواة للإلكترونات فيكون من الصعب نزع الإلكترون.
60. كيف يمكن مقارنة نصف قطر أيون اللافلز بنصف قطر الذرة؟ فسر ذلك.
الحل:
يكون اللافلز عند تفاعله أيون سالب ويكون هذا الأيون السالب نصف قطره أكبر من نصف قطر الذرة وذلك بسبب التنافر بين إلكترونات المستوى الأخير فيزيد الحجم.
61. فسر لماذا يقل نصف قطر الذرة كلما اتجهنا من اليسار إلى اليمين عبر الدورة؟
الحل:
كلما اتجهنا من اليسار على اليمين في نفس الدورة تزداد شحنة النواة الموجبة وذلك يزيد من قوة جذب النواة للإلكترونات فيقل الحجم.
62. حدد أي العنصرين له أكبر طاقة تأين في كل من الأزواج الآتية؟
a. Li, Na
b. Kr, Ne
c. Cs, Li
الحل:
a. النيتروجين N أكبر في طاقة التأين.
b. النيون Ne أعلى في طاقة التأين.
c. الليثيوم Li هو الأعلى في طاقة التأين.
63. ما المقصود بالقاعدة الثمانية؟ ولماذا لا يتبع غازا الهيدروجين والهيليوم هذه القاعدة؟
الحل:
القاعدة الثمانية هي أن الذرة تفقد أو تكسب أو تشارك بالإلكترونات للحصول على ثمانية إلكترونات تكافؤ في مستوى الطاقة الأخير. ولكن الهيليوم والهيدروجين حالة الاستقرار لهما هي ثنائية عندما يحتوي المستوى الفرعي الوحيد، على إلكترونين.
64. استخدم الشكل 20-2 للإجابة عن الأسئلة الآتية، فسر إجابتك.
a. إذا كانتA تمثل أيونًا، وB تمثل ذرة للعنصر نفسه. فهل يكون الأيون موجبا أم سالبا؟
b. إذا كان A وB يمثلان نصفي قطري ذرتي عنصرين في الدورة نفسها، فما ترتيبهما في الدورة؟
c. إذا كان A وB يمثلان نصفي قطري أيونين العنصرين في المجموعة نفسها، فما ترتيبهما في المجموعة؟
الحل:
a. نلاحظ أن حجم الايون أكبر من الذرة المتعادلة لذلك فهو أيون سالب.
b. الذرة A الكبيرة الحجم تقع في اليسار بينما الذرة B تقع على يمينها لأنها الأقل في الحجم.
c. الأيونين في نفس المجموعة فأن الأيون B يقع في الأسفل لأنه الأكبر في الحجم.
65. يمثل الشكل 21 - 2 طريقتين لتعريف نصف قطر الأيون. صف كل طريقة، واذكر متى تستخدم كل منهما؟
الحل:
a. نصف القطر (نصف المسافة بين نواتين متجاورتين في التركيب البلوري للعناصر الموجودة في شكل جزيئات) وتستخدم للفلزات.
b. نصف القطر (نصف المسافة بين نوى ذرات متطابقة ومتحدة كيميائياً) وتستخدم للافلزات.
66. الكلور التوزيع الإلكتروني لذرة الكلور هو Ne]3s2 3p5] وعندما يكتسب إلكترونـا يصبح توزيعه الإلكتروني Ne]3s2 3p6]، وهو التوزيع الإلكتروني للأرجون. فهل تغيرت ذرة الكلور إلى ذرة أرجون؟ فسر إجابتك.
الحل:
لا، لم تتغير ذرة الكلور للأرجون، ولكن طبقاً لقاعدة الثمانيات فإن ذرة الكلور أصبحت تحتوي على ثمانية إلكترونات وممتلئة فتكون تشبه الغاز الخامل في الاستقرار.
إتقان حل المسائل
67. تصنع بعض العبوات من مادة اللكسان Lexan، وهي مادة بلاستيكية يدخل في تركيبها مركب مكون من الكلور والكربون والأكسجين. رتب هذه العناصر تنازليا حسب نصف قطر الذرة ونصف قطر الأيون.
الحل:
الكلور، الكربون، الأكسجين.
68. العدسات الـ اللاصقة تصنع العدسات اللاصقة المرنة من اتحاد ذرات السليكون والأكسجين معا. اعمل جدولاً يحتوي قائمة بالتوزيع الإلكتروني وأنصاف أقطار كل من ذرات وأيونات السليكون والأكسجين. ثم اشرح أي الذرات تصبح أكبر، وأيها تصبح أصغر عند اتحاد السيليكون بالأكسجين؟ ولماذا؟
الحل:
ذرة السيلكون تكون أكبر حجماً من ذرة الأكسجين، بينما أيون الأكسجين أكبر من أيون السيلكون. يصبح الأكسجين أكبر بينما يقل السيلكون (بينهما علاقة عكسية)
69. المحلي الصناعي تحتوي بعض المشروبات الغازية التي تجنب زيادة الوزن على المحلي الصناعي أسبارتيهم وهو مركب يحتوي على الكربون والنيتروجين والأكسجين وذرات أخرى. اعمل جدولاً يوضح أنصاف أقطار الذرات، والأيونات للكربون، والنيتروجين، والأكسجين. افترض حالة التأين الموضحة في الشكل 14-2 واستخدم الجدول الدوري للتنبؤ بما إذا كانت حجوم ذرات الكربون والنيتروجين والأكسجين تتزايد أم تتناقص عند تكوين الروابط الكيميائية في الأسبارتيم.
الحل:
يقع كل من الكربون والأكسجين والنيتروجين في دورة واحدة، ولكن يقع الكربون في اليسار بينما الأكسجين يقع في اليمين لذلك الكربون يكون أكبر حجما من الأكسجين. وفي الحالة الأيونية يكتسب النتروجين 3 إلكترونات ويصبح أيون سالب ويكون الأكبر حجماً ويكتسب الأكسجين إلكترونين بينما يفقد الكربون 4 لإلكترونات ولذلك يكون الأقل حجماً.
مراجعة عامة
70. عرف الأيون.
الحل:
هو ذرة عنصر فقدت او اكتسبت او شاركت إلكترونات لتتحول إلى أيون موجب أو سالب.
71. اشرح لماذا لا يمكن قياس نصف قطر الذرة بطريقة مباشرة؟
الحل:
لأن الذرة صغيرة جدا ولا يوجد لها نهاية محددة لذلك يصعب تحديد المسافة بين النواة وأبعد إلكترون عنها.
72. ما شبه الفلز في الدورة 2 من الجدول الدوري، الذي يكون جزءًا من مركب يستعمل لإزالة عسر الماء؟
الحل:
البورون هو شبة الفلز الذي يقع في الدورة الثانية.
73. أيهما أكثر كهروسالبية : عنصر السيزيوم في المجموعة 1 المستخدم في مصابيح الأشعة تحت الحمراء، أم البروم وهو الهالوجين المستخدم في مركبات مقاومة الحريق؟ ولماذا؟
الحل:
البروم هو الأكثر سالبية لأن له القدرة على جذب إلكترون خارجي ليكون أيون سالب مكتمل أما السيزيوم أقل سالبية كهربية.
74. يوضح الشكل 22-2 فئات الجدول الدوري. سم كل فئة من الجدول الدوري، واشرح الخواص المشتركة بين عناصر كل فئة.
الحل:
الفئة الصفراء هي الفئة s ويتم امتلاء المستوى الثانوي s
الفئة الزرقاء هي الفئة d ويتم امتلاء المستوى الثانوي d
الفئة البنفسجي هي الفئة p ويتم امتلاء المستوى الثانوي p
الفئة الخضراء هي الفئة f ويتم امتلاء المستوى الثانوي f
75. أي عنصر في الأزواج الآتية له كهروسالبية أعلى:
a. As أو K
b. Sb أو N
c. Be أو Sr
الحل:
a. As هو الأعلى سالبية كهربية
b. N هو الأعلى سالبية كهربية
c. Be هو الأعلى سالبية كهربية
76. فسر لماذا تمتد الفئة 8 من الجدول الدوري على هيئة مجموعتين، والفئة p على هيئة 6 مجموعات، والفئة d على هيئة 10 مجموعات؟
الحل:
الفئة s تحتوي على مستوى فرعي واحد يمتلئ بإلكترونين لذلك توجد على هيئة مجموعتين الفئة p تحتوي على ثلاثة مستويات فرعية ممتلئة بستة إلكترونات لذلك تقع على هيئة ستة مجموعات، الفئة d تحتوي على خمسة مستويات فرعية ممتلئة بعشرة إلكترونات لذلك فهي تقع على هيئة عشرة مجموعات.
77. لماذا تختلف معظم قيم الكتل الذرية في جدول مندليف عن القيم الحالية؟
الحل:
لأنه لم يكن هناك قياسات دقيقة للكتل الذرية ومعرفة النظائر في زمن العالم مندليف.
78. رتب العناصر - الأكسجين والكبريت والتيلريوم والسلينيوم - تصاعديا حسب نصف قطر الذرة. وهل يعد ترتيبك مثالاً على تدرج الخواص في المجموعة أم في الدورة؟
الحل:
يدل الترتيب على تدرج الخواص في المجموعة، وخلال المجموعة يزداد نصف القطر كلما اتجهنا من أعلى إلى أسفل لذلك الترتيب التصاعدي لنصف القطر هو الأكسجين الكبريت، السيلينيوم ثم الأكبر التيلريوم.
79. الحليب يعد العنصر ذو التوزيع الإلكتروني 4s2 [Ar] من أهم الفلزات الموجودة في الحليب. حدد مجموعة ودورة وفئة هذا العنصر في الجدول الدوري.
الحل:
العنصر هو الكالسيوم ورمزه Ca وموقعه في الدورة 4 المجموعة 2، الفئة s.
80. لماذا لا توجد عناصر من الفئة p في الدورة الأولى؟
الحل:
لأن الفئة p تبدأ بالظهور في الدورة 2 بوجود المستوى الثانوي p في مستوى الطاقة الرئيسي الثاني.
81. المجوهرات ما الفلزان الانتقاليان المستخدمان في صناعة المجوهرات، واللذان يقعان في المجموعة 11، ولهما أقل كتلة ذرية؟
الحل:
سيكون العنصران هما النحاس والفضة وهما الأقل من حيث الكتلة الذرية.
82. أيهما له طاقة تأين أكبر البلاتين المستخدم في عمل تاج الضروس، أم الكوبلت الذي يُكسب الفخار ضوءه الأزرق الساطع؟
الحل:
البلاتين يكون أكبر حجماً من الكوبلت ولكن غير نشط كيميائياً ويحتاج إلى طاقة أكبر لانتزاع إلكترون من مستواه.
التفكير الناقد
83. طبق يكون الصوديوم Na أيونا موجبًا 1+؛ في حين يكون الفلور أيونا سالبا .1- اكتب التوزيع الإلكتروني لكل أيون منهما. وفسّر لماذا لا يشكل هذان العنصران أيونات ثنائية؟
الحل:
العدد الذري للصوديوم = 11 وعندما يتحول لأيون موجب يفقد إلكترون ويكون عدد الإلكترونات 10 إلكترونات وسوف يكون التوزيع الإلكتروني 1s2 2s2 2p6 ولا يشكل الصوديوم أيون ثنائي لأن ذلك يؤدي إلى فقد من مستوى طاقة ممتلئ.
الفلور عدد إلكتروناته = 9 إلكترونات وعندما تكسب إلكترون يصبح 10 إلكترونات ويتحول لأيون سالب وسوف يكون توزيعه الإلكتروني
1s2 2s2 2p6 ولا يشكل الفلور أيون ثنائي لأن الذرة لا تكون مستقرة عند عندما لا يكون المستوى غير ممتلئ.
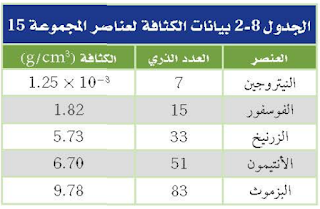
84. اعمل رسم بيانيا واستخدمه استعن بالبيانات الواردة في الجدول 8-2 ومثل بيانيا الكثافة مقابل العدد الذري واذكر أي نمط تغير يمكن أن تلاحظه.
الحل:
تزداد الكثافة خلال الدورة الواحدة كلما اتجهنا من اليسار إلى اليمين خلال الدورة الواحدة بزيادة العدد الذري وتزداد الكثافة كلما اتجهنا من أعلى إلى أسفل خلال المجموعة.
85. فسر البيانات رسمت درجات انصهار عناصر الدورة 6 مقابل العدد الذري كما في الشكل 23-2. حدد نمط التغير في درجات الانصهار والتوزيع الإلكتروني للعناصر، ثم ضع فرضية لتفسير هذا النمط.
الحل:
كلما اتجهنا من الدورة السادسة من اليسار إلى اليمين يزداد درجة الانصهار إلى أن تصل إلى القمة لعنصر التنجستن ثم يقل درجة الانصهار لذلك في آخر الدورة نجد العناصر في حالة غازات.
86. التعميم يعبر الرمز 1ns عن التوزيع الإلكتروني للمستوى الخارجي لعناصر المجموعة الأولى، حيث n هو رقم دورة العنصر ومستوى طاقته الرئيس. اكتب رمزًا مشابهًا لكل مجموعات العناصر الممثلة.
الحل:
المجموعة 2 = ns2
المجموعة 13 = ns2 np1
المجموعة 14 = ns2 np2
المجموعة 15 = ns2 np3
المجموعة 16 = ns2 np4
المجموعة 17 = ns2 np5
المجموعة 18 = ns2 np6
87. تعرف أحد العناصر الممثلة في الدورة 3 جزء من المواد الخشنة التي تستعمل على سطوح علب الثقاب. والجدول 9-2 يوضح طاقات التأين لهذا العنصر. استعن بالمعلومات الواردة في هذا الجدول لاستنتاج نوع العنصر.
الحل:
العنصر هو الفسفور P.
مسألة تحفيز
88. يعبر عن طاقات التأين بوحدة (kJ /mol)، إلا أنه يعبر عن الطاقة اللازمة لانتزاع إلكترون من الذرة بالجول (1). استخدم القيم في الجدول 5-2 لحساب الطاقة اللازمة لانتزاع الإلكترون الأول بوحدة الجول من ذرة كل من B وBe، وLi، وC، ثم استخدم العلاقة 19-10 × 1.6 = leV لتحويل القيم إلى الإلكترون فولت.
الحل:
للتحويل من كيلو جول إلى جول نضرب في 1000
ونقوم بالقسمة على كل طاقة التأين الاول بالجول على قيمة الإلكترون فولت وهي (1019 × 1.6)
وسوف تكون النتائج لكل عنصر كالتالي:
Li: 8.64 × 10-19 J Or 5.4 eV
Be: 1.50 × 10-18 J Or 9.38 eV
B: 1.33 × 10-18 J Or 8.31 eV
C: 1.81 × 10-18 J Or 11.3 eV
مراجعة تراكمية
89. عرف المادة، وحدد ما إذا كان كل مما يأتي مادة أم لا.
a. موجات الميكروويف
b. الهيليوم داخل بالون
c. حرارة الشمس
d. السرعة
e. ذرة من الغبار
f. اللون الأزرق
الحل:
المادة هي كل جسم له كتلة وحجم ويشغل حيز من الفراغ.
a. ليست مادة
b. مادة
c. ليست مادة
d. ليست مادة
e. مادة
f. ليست مادة
90. حوّل كلًا من وحدات القياس الآتية إلى ما هو مبين:
a. cm إلى m
b. 76.2 pm إلى mm
c. 11 mg إلى kg
d. 7.23 mg إلى kg
الحل:
a. cm = 1.1 ×10-2 m.
b. 76.2 pm = 7.62 × 10-8 mm
c. 11 mg = 1.1 × 104 kg
d. 7.23 mg = 7.23 × 10-6 kg
91. ما العلاقة بين الطاقة التي تنبعث من الإشعاع وتردده؟
الحل:
طاقة الفوتون = تردد الموجة × ثابت بلانك
92. ما العنصر الذي توزيعه الإلكتروني Ar] 4s2 3d6] وهو في حالة الاستقرار؟
الحل:
العنصر هو الحديد Fe وعدده الذري = 26
تقويم إضافي
الكتابة في الكيمياء
93. الثلاثيات في بدايات القرن التاسع عشر اقترح الكيميائي الألماني دوبيرنر ما يعرف باسم الثلاثيات. ابحث عن ثلاثيات دوبيرنر، واكتب تقريرًا حولها. ما العناصر التي تمثل الثلاثيات؟ وكيف كانت صفات العناصر فيها متشابهة؟
الحل:
ثلاثيات دوبيرنر:
في عام 1817، اقترح الكيميائي الألماني يوهان دوبيرنر مجموعة من العناصر المترابطة بخصائص متشابهة والتي أطلق عليها اسم "الثلاثيات". هذه الثلاثيات تتكون من ثلاثة عناصر كيميائية ذات خصائص متقاربة.
العناصر التي تمثل الثلاثيات:
دوبيرنر لاحظ أن هناك ثلاثة عناصر كيميائية تشترك في خصائص متشابهة في كل مجموعة. بعض الثلاثيات التي اقترحها دوبيرنر هي:
· الكالسيوم، الباريوم، والاسترونتيوم
· الكلور، البروم، واليود
· الليثيوم، الصوديوم، والبوتاسيوم
الصفات المتشابهة للعناصر في الثلاثيات:
دوبيرنر لاحظ أن العناصر في كل ثلاثية تشترك في العديد من الخصائص الكيميائية والفيزيائية المتشابهة، مثل:
· الخواص الفيزيائية كالكثافة والنقطة الانصهار والغليان
· التفاعلات الكيميائية والسلوك التأكسدي-اختزالي
· الخواص الطيفية وطرق الكشف عنها
· الموقع في الجدول الدوري للعناصر
94. الميل الإلكتروني خاصية دورية أخرى. اكتب تقريرا عن الميل الإلكتروني، وصف تدرجه عبر المجموعة وعبر الدورة.
الحل:
الميل الإلكتروني:
الميل الإلكتروني هو قياس لقدرة ذرة على جذب إلكترون إلى نفسها عند تكوين رابطة كيميائية. وهو خاصية دورية للعناصر تتأثر بعدة عوامل كالحجم الذري والشحنة النووية والتوزيع الإلكتروني.
التدرج عبر المجموعات:
· كلما زاد العدد الذري للعنصر (أي انتقلنا إلى أسفل المجموعة)، زاد حجم الذرة وبالتالي قل قدرتها على جذب الإلكترونات.
· لذلك، الميل الإلكتروني ينخفض عند الانتقال إلى أسفل المجموعة.
· مثال: الميل الإلكتروني لليثيوم (3Li) أكبر من الميل الإلكتروني للصوديوم (11Na) والبوتاسيوم (19K).
التدرج عبر الدورات:
· كلما زاد العدد الذري للعنصر (أي انتقلنا إلى اليمين في الجدول الدوري)، زادت الشحنة النووية وتقلص حجم الذرة.
· لذلك، الميل الإلكتروني يزداد عند الانتقال إلى اليمين في الدورة.
· مثال: الميل الإلكتروني للفلور (9F) أكبر من الميل الإلكتروني للكلور (17Cl) واليود (53I).
يُعد الميل الإلكتروني خاصية مهمة في فهم التفاعلات الكيميائية والرابطة الكيميائية، كما أنه يفسر البعض من الخواص الدورية للعناصر.
أسئلة المستندات
كان الجدول الدوري الأصلي لمندليف جديرا بالملاحظة في ضوء المعلومات التي كانت متوافرة عن العناصر المعروفة في حينه، لذلك فهو يختلف عن النسخة الحديثة. قارن بين جدول مندليف الموضح في الجدول 10-2 والجدول الدوري الحديث الموضح في الشكل 5-2.
95. وضع مندليف الغازات النبيلة في يسار الجدول. فلماذا يعد وضع هذه العناصر في نهاية الجدول - كما في الجدول الدوري الحديث (المجموعة 18) منطقيا أكثر؟
الحل:
وضع الغازات النبيلة في الجهة اليمنى يجعل العناصر الممثلة مرتبة من اليسار إلى اليمين (كلما تم تعبئة مستويات الطاقة تستقر الغازات النبيلة التي لها مستويات خارجية ممتلئة على الجهة اليمنى)
96. أي أجزاء جدول مندليف يعد أكثر تشابها مع موقعه الحالي، وأيها كان أبعد عن موقعه الحالي في الجدول الحديث؟ ولماذا؟
الحل:
يعد الهيليوم هو العنصر الذي يشبه عناصر الفئة s وتعد عناصر الفئة f الأقل تشابها مع الهيليوم. وفي ذلك الوقت كانت عناصر الفئة s هي المعروفة على نحو واسع على عكس عناصر الفئة f الذي كانت تعرف قليلاً.
97. تختلف معظم الكتل الذرية في جدول مندليف عن القيم الحالية. ما سبب ذلك؟
الحل:
بسبب اختلاف طرق العلماء في قياس الكتل الذرية.
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"
بالتوفيق للجميع...^-^




















ليست هناك تعليقات:
إرسال تعليق